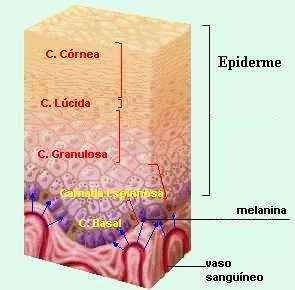
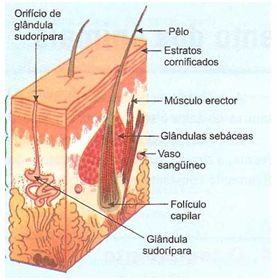
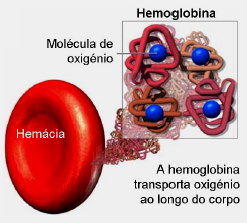
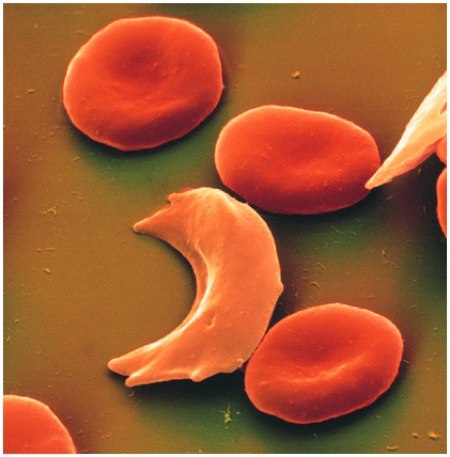
COLORAÇÃO AZUL DE TOLUIDINA
Colocar as lâminas em água destilada por 10 min
Azul de toluidina Merk ..................................2 min
Água corrente................................................5 min
Obs: Pode-se fazer uma lâmina teste para ver a coloração. Aumentar e diminuir o tempo de acordo com os resultados.
COLORAÇÃO PAS
Preparo de Soluções
Ácido Periódico:
Ac. Periódico...................................1g
200 ml de água destilada
HCl 1N:
HCl 37%...........................................80,4ml
Água destilada................................919,6ml
Água Sulfurosa:
Metabissulfito de sódio 10%...................36ml
HCl 1N.............................................30ml
Completar para 600ml com água destilada e Dividir em 3 frascos de 200ml cada
Reativo de Schiff
Fucsina Básica.................................2g
HCl 1N..........................................20ml
Metabissulfito de Sódio....................2g
Carvão Ativado.................................4g
Água destilada............................400ml
Técnica para preparar o Schiff:
Ferver a água destilada em um balão volumétrico ou erlemeyer
Remover do calor e adicionar a fucsina básica lentamente agitando (aprox. 5min)
Deixar esfriar para 50°C e adicionar o HCl. Filtrar
Esfriar para 25°C e adicionar o metabissulfito. Agitar bem (aprox. 1hora).
Envolver o recipiente em papel alumínio ou saco preto.
Deixar no escuro overnight.
No dia seguinte, adicionar o carvão e filtrar imediatamente. O filtrado deve se tornar incolor.
TÉCNICA PAS METACRILATO
Colocar as lâminas em água destilada por 10 minutos. Durante esse tempo, preparar o ácido periódico.
Ac. Periódico........................15 min
Água destilada.................. ...10 min
Reagente de Schiff..............45 min
Água Sulfurosa I ...................5 min
Água Sulfurosa II ...................5 min
Água Sulfurosa III ..................5 min
Lavar as lâminas em água corrente por 20 minutos.
Deixá-las na hematoxilina de Myers por 35 minutos.
Lavar novamente em água corrente por 10 minutos.
Secar e montar.
Tempo estimado: 3 horas
Obs: O tempo incubação no reagente de Schiff pode variar segundo a intensidade de coloração dos cortes.
TÉCNICA PAS PARAFINA
Xilol I.........10 min
Xilol II........10 min
Xilol III.......10 min
Álcool absoluto I............1 ou 2 min
Álcool absoluto II.................10 min
Álcool 95%............................5 min
Álcool 85%............................5 min
Álcool 70%............................5 min
Água Corrente.......................5 min
Ácido Periódico 0,5%..........15 min
Lavar em água corrente........5 min
Reativo de Schiff.................20 min (olhar se corou bem, caso não; deixar mais tempo)
Água Sulfurosa I...................5 min
Água Sulfurosa II..................5 min
Água Sulfurosa III.................5 min
Lavar em água corrente......20 min
Hematoxilina.........................5 min
Lavar em água corrente......30 min
Álcool 70%............................5 min
Álcool 85%............................5 min
Álcool 95%............................5 min
Absoluto I..............................5 min
Absoluto II............................10min
Absoluto III...........................15min
Xilol I.......................................5 min
Xilol II.....................................10min
Xilol III....................................15min
COLORAÇÃO DE Hematoxilina e Eosina em Parafina
Preparo de soluções:
Solução saturada de ácido pícrico
Ac. Pícrico............................... 1,3g
Água destilada........................ 100ml
Preparo da Eosina (fórmula Maristane)
Eosina amarelada.............................1,0g
Álcool Absoluto.................................10 ml
Bicromato de potássio.......................0,5 g
Água destilada...................................80ml
Solução saturada de ac. Pícrico.......10 ml
Dissolver a eosina em 10 ml de álcool absoluto.
Dissolver o bicromato em 80 ml de água e adicionar as soluções de ácido pícrico e de eosina.
Etapas
Xilol I........................10 min
Xilol II.......................10 min
Xilol III......................10 min
Álcool absoluto...1 ou 2 min
Álcool absoluto.........10 min
Álcool 95%.................5 min
Álcool 85%.................5 min
Alcool 70%.................5 min
Água corrente.............5 min
Hematoxilina.............20 min
Água Corrente..........20 min
Eosina.........................1 min
Álcool 85%.................mergulhar
Álcool 95%..............3 a 5 min
Álcool Absoluto.........10 min
Alcool Absoluto.........10 min
Álcool Absoluto.........15 min
Xilol I...........................5 min
Xilol II..........................5 min
Xilol III.........................5 min
![[he.jpg]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiJTU14QQzCppdOhTAoccsWfczRWu24t89PpwiButR_QNFKll5fROSU1B4P-WczZ3AsjKYVpnF13d215gxkqoxotEHMRF86yE2zS-SkowuI2TfPITHrVuxe8zWfvIYGHEE-6x1rBz2Ffcs/s400/he.jpg) |
| Fonte: https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiJTU14QQzCppdOhTAoccsWfczRWu24t89PpwiButR_QNFKll5fROSU1B4P-WczZ3AsjKYVpnF13d215gxkqoxotEHMRF86yE2zS-SkowuI2TfPITHrVuxe8zWfvIYGHEE-6x1rBz2Ffcs/s1600/he.jpg |
FONTES:
http://www.icb.ufmg.br/mor/pad-morf/coloracao.htm
http://www.fiocruz.br/ioc/cgi/cgilua.exe/sys/start.htm?infoid=1723&sid=32
http://2.bp.blogspot.com/_VyJBIvMWX04/ReHtSKoCzKI

















![[he.jpg]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiJTU14QQzCppdOhTAoccsWfczRWu24t89PpwiButR_QNFKll5fROSU1B4P-WczZ3AsjKYVpnF13d215gxkqoxotEHMRF86yE2zS-SkowuI2TfPITHrVuxe8zWfvIYGHEE-6x1rBz2Ffcs/s400/he.jpg)